乳腺癌治疗新突破!Biomed Pharmacother:3D生物打印技术与柠檬来源细胞外囊泡相结合,构建高效双重递送系统
来源:生物谷原创 2024-12-25 09:34
该研究通过3D生物打印GelMA支架负载柠檬来源EVs,联合DOX在3D TNBC模型中展现出协同增效,从多方面影响细胞行为,为TNBC治疗带来新希望与策略。

乳腺癌是全球女性健康的重大威胁,而三阴性乳腺癌(TNBC)因其特殊的生物学特性,治疗难度颇高。TNBC占乳腺癌病例的15-20%,由于缺乏雌激素受体、孕激素受体和HER2的表达,传统的激素疗法和靶向治疗对其效果不佳,化疗成为主要的治疗手段。然而,化疗药物如阿霉素(DOX)在治疗过程中存在全身毒性和耐药性等问题,迫切需要新的治疗策略。
最近,意大利天主教圣心大学研究团队在Biomed Pharmacother发表了题为Plant-derived extracellular vesicles release combined with systemic DOX exhibits synergistic effects in 3D bioprinted triple-negative breast cancer的研究论文,成功构建了一种基于3D生物打印的创新双重递送系统,将柠檬来源的细胞外囊泡(CLEVs)与DOX相结合,为TNBC治疗提供了新的方向。

CLEVs具有良好的生物相容性、安全性和易于生产的特性,相较于哺乳动物细胞来源的EVs更具优势。为了实现药物的精准递送,研究团队采用3D生物打印技术,将CLEVs嵌入到明胶甲基丙烯酰基(GelMA)支架中,制备出具有特定结构的支架贴片。GelMA支架本身具有优异的生物相容性和可调节的机械性能,能够为治疗剂的封装和控释提供理想的平台。
在研究过程中,科研人员首先对该系统的性能进行了评估。利用原子力显微镜(AFM)对支架的机械性能进行了详细分析。结果显示,95%甲基丙烯酸化的GelMA支架刚度更高,其杨氏模量是50%甲基丙烯酸化支架的两倍。这一特性不仅保证了支架的稳定性,还对EVs的释放产生了重要影响。在探究EVs从支架的释放规律时,研究人员发现支架的刚度、交联光强度以及物理孔隙率均在释放过程中起着关键作用。EVs能够从支架中持续释放长达7天,其中95%甲基丙烯酸化且在75%和100%光强度交联下的支架,以及具有0.1 mm立方填充网格结构的支架,释放效果最为理想。
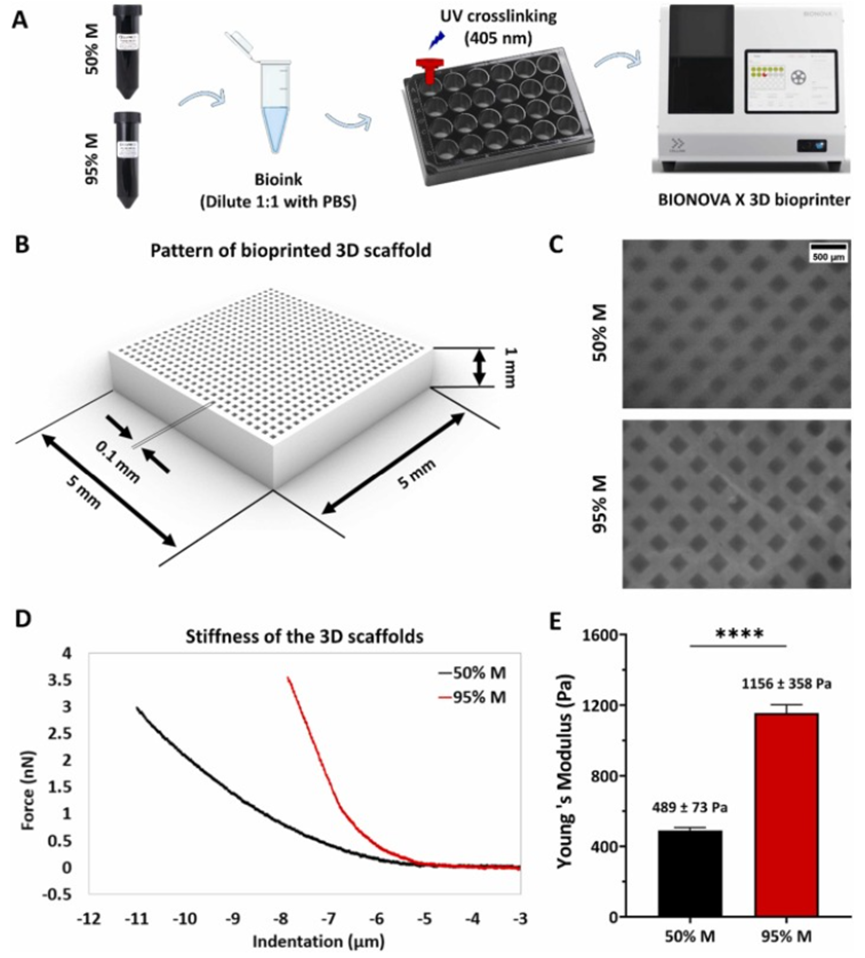
图1. 生物打印3D支架的制造和表征
细胞摄取实验表明,EVs和DOX单独或联合处理时,均能高效地被HCC-1806细胞摄取。联合处理时,EVs主要聚集在细胞质中,而DOX则主要集中于细胞核内,这表明二者的协同作用并未干扰彼此的摄取,为联合治疗的可行性提供了有力依据。
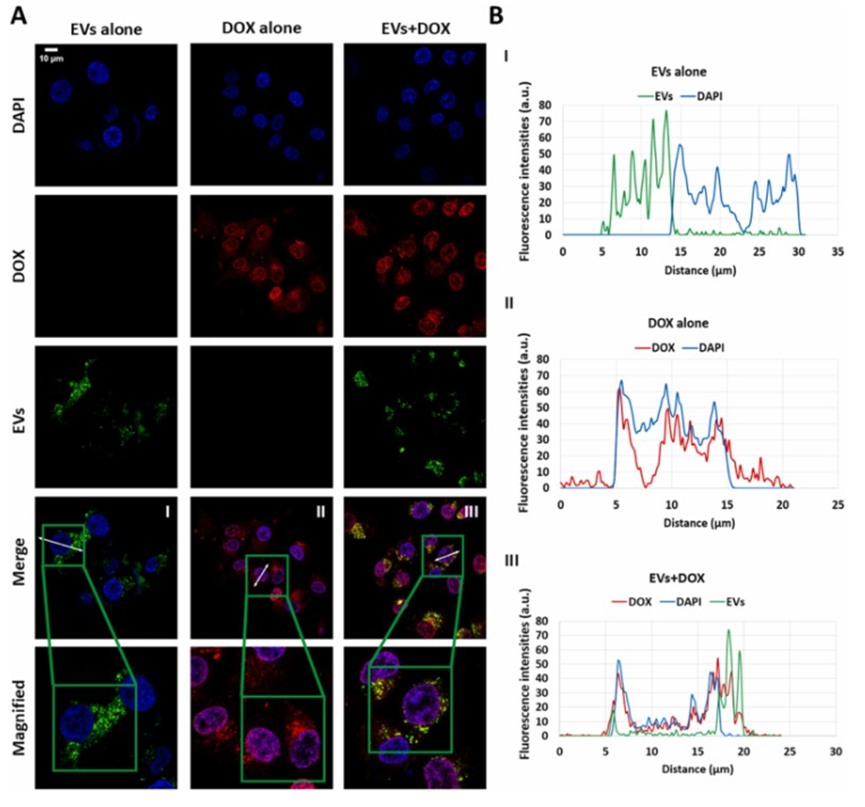
图2. HCC-1806细胞对EVs、DOX以及EVs+DOX的细胞摄取情况
进一步的实验表明,在3D TNBC模型中,DOX对癌细胞表现出明显的剂量依赖性细胞毒性,其IC50为0.344 μg/mL。同时,DOX诱导了细胞内活性氧(ROS)水平的显著升高,这是细胞死亡的早期关键事件。而当EVs支架贴片与DOX联合使用时,协同效应显著增强。在48小时和7天的孵育过程中,联合治疗组的细胞活力大幅降低,ROS产生水平显著升高,且对细胞迁移和聚集产生了强大的抑制作用。
在侵袭性TNBC模型中,联合治疗策略依然发挥强大的抗癌作用。从细胞行为观察来看,联合治疗能够有效抑制细胞的增殖和迁移,显著降低细胞密度。具体而言,在处理后的第7天,联合治疗组的核心细胞密度相较于对照组降低了约60%,这一结果表明联合治疗在应对侵袭性肿瘤方面具有显著优势,为治疗转移性TNBC提供了重要的实验依据。
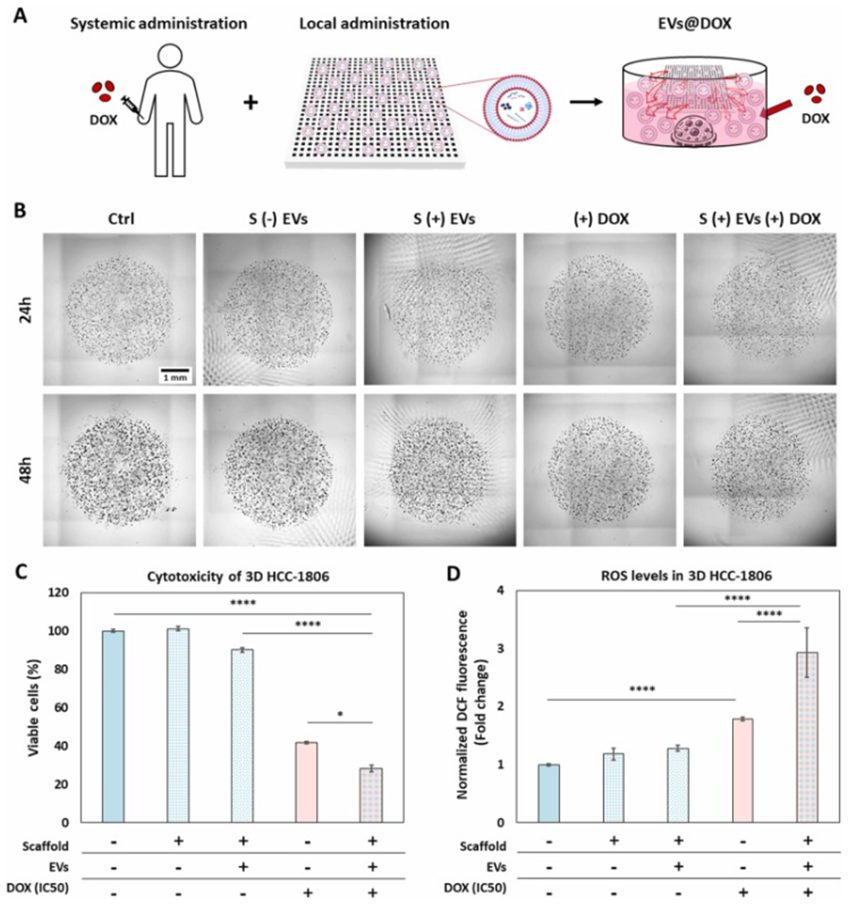
图3. EVs贴片与DOX的组合协同增强了对3D TNBC模型的抗癌效果
值得一提的是,EVs嵌入式支架还展现出对细胞的双向调节作用。EVs嵌入式支架不仅对癌细胞产生抑制作用,还对成纤维细胞展现出积极的影响。在成纤维细胞中,支架表现出良好的生物相容性,促进了细胞的增殖,增强了细胞的黏附能力,加速了伤口愈合过程。而对于HCC-1806癌细胞,支架则明显抑制其生长,这种对不同细胞类型的差异化作用使得支架在肿瘤治疗和组织修复方面具有独特的应用潜力。
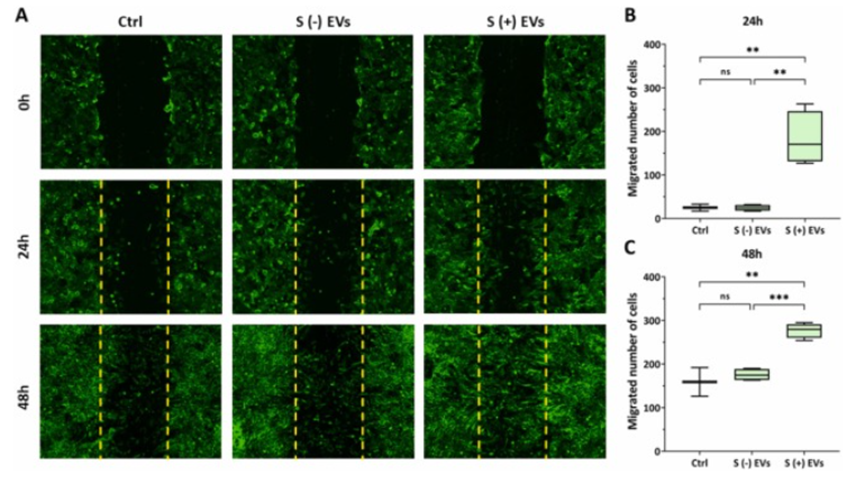
图4. EVs嵌入式支架加速成纤维细胞伤口闭合
综上所述,本研究创新性地将3D生物打印技术与天然来源的细胞外囊泡相结合,构建了一种高效的双重递送系统。这一系统在TNBC治疗中展现出卓越的协同效应,显著降低了癌细胞的活力、聚集和迁移能力。这一研究成果为TNBC治疗开辟了新的方向,有望在未来为患者带来更有效、更安全的治疗方案,大幅改善患者的预后和生活质量。(生物谷Bioon.com)
参考文献:
Cui L, Perini G, Minopoli A, et al. Plant-derived extracellular vesicles release combined with systemic DOX exhibits synergistic effects in 3D bioprinted triple-negative breast cancer. Biomed Pharmacother. Published online October 30, 2024. doi:10.1016/j.biopha.2024.117637
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


